06/02/2017
USP de Ribeirão Preto terá primeiro centro de pesquisa em canabidiol do país
Projeto já tem estudo aprovado sobre uso do canabidiol em crianças e adolescentes com epilepsia refratária
A Faculdade de Medicina da Universidade de São Paulo (USP) inaugura ainda este ano, no campus da cidade de Ribeirão Preto, o Centro de Pesquisas em Canabinoides, substâncias derivadas da maconha, mais especificamente da Cannabis sativa. O centro vai funcionar em uma ampliação do prédio da Saúde Mental da Universidade e deve estar pronto no segundo semestre.
O projeto, inédito no Brasil, vai analisar a resposta do canabidiol em mais de 120 crianças e adolescentes que sofrem com epilepsia refratária, ou seja, quando medicamentos tradicionais não fazem efeitos. Nesse estudo, o novo centro terá uma ala destinada à pesquisa básica de laboratórios e outra voltada à pesquisa clínica com os pacientes e voluntários.
Além da epilepsia, a Doença de Parkinson e a esquizofrenia também estão entre as enfermidades que “possuem ensaios clínicos em pacientes, porém ainda precisam de estudos com maior número de pacientes para que o canabidiol possa ser registrado como medicamento pelas agências reguladoras”, explica o professor Antonio Waldo Zuardi, do Departamento de Neurociências e Ciências do Comportamento da FMRP e coordenador do novo centro.
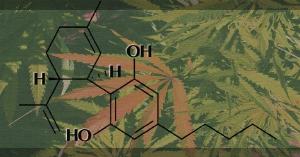 Estrutura
química do Canabidiol. (Foto: NIDA(NIH))
Estrutura
química do Canabidiol. (Foto: NIDA(NIH))O estudo na USP
Antes proibido, o canabidiol recebeu autorização da Agência Nacional de Vigilância Sanitária (Anvisa) em março do ano passado. Foi permitida a prescrição médica e a importação, por pessoa física, de medicamentos e produtos com canabidiol e tetrahidrocannabinol (THC) em sua formulação para uso próprio em tratamento de saúde.
O canabidiol, no entanto, ainda não está registrado no país, pois não teve a sua segurança e eficácia comprovadas pela vigilância sanitária brasileira. Para isso, os pesquisadores da USP vão usar o centro para testar a substância e, futuramente, disponibilizá-la para a população.
* * *
Confira a linha do tempo do uso da cannabis para fins terapêuticos:
Novembro 2013
Após ver informações na internet sobre testes com canabidiol, um dos derivados da maconha, a família da brasileira Anny Fischer, que sofre de uma síndrome rara, decide importar dos Estados Unidos um óleo rico na substância para a criança.
Março 2014
Uma das tentativas de importação falha e o canabidiol é barrado na alfândega. A família conta sua história a um jornalista, que lança o documentário "Ilegal" sobre o caso.
Abril 2014
A família de Anny consegue laudo médico da USP de Ribeirão Preto e entra na Justiça para conseguir importar o produto. O pedido é aprovado. Após o caso, a Anvisa (Agência Nacional de Vigilância Sanitária) passa receber mais pedidos de autorização para importação de produtos à base de canabidiol.
9 de Outubro de 2014
Conselho Regional de Medicina de São Paulo publica a Resolução CREMESP nº 268, autorizando a prescrição de canabidiol no Estado.
8 de Novembro de 2014
Conselho Regional de Medicina do Paraná promove palestra e debate sobre o tema em evento realizado em Curitiba.
16 de dezembro de 2014
Conselho Federal de Medicina publica a Resolução CFM 2.113/2014, autorizando médicos Neurologistas a prescreverem o canabidiol, mas somente para crianças com epilepsia e que não tenham tido sucesso em outros tratamentos.
14 de Janeiro de 2015
Anvisa libera uso medicinal de produtos à base de canabidiol, um dos derivados da maconha, retirando-o de uma lista de substâncias proibidas e colocando-o em uma lista de substâncias controladas.
Março de 2015
Cresce volume de decisões judiciais que obrigam a União a fornecer o canabidiol a pacientes com diferentes tipos de crises convulsivas, não apenas as epiléticas.
23 de abril de 2015
Anvisa simplifica regras para importação de produtos à base de canabidiol e cria lista de produtos que podem ter facilitado processo de autorização para importar.
Agosto e Setembro de 2015
STF começa a discutir se é crime portar drogas para uso próprio. Julgamento, no entanto, foi suspenso após pedido de vistas do ministro Teori Zavascki.
21 de Março de 2016
Após determinação judicial, Anvisa publica resolução que autoriza prescrição e importação de medicamentos com THC, um dos princípios ativos da maconha. Antes, essa substância fazia parte da lista daquelas que não poderiam ser objeto de prescrição médica e manipulação de medicamentos no país.
22 de Novembro de 2016
Anvisa aprova critérios para uso de medicamento à base de maconha e abre espaço para que remédios à base da planta possam obter registro para venda no país.
Novembro e Dezembro de 2016
Três famílias, duas do RJ e uma de SP, conseguem habeas corpus que as permitem plantar e extrair óleo de maconha para uso medicinal e próprio.
Fontes: CRM-PR com Agência Brasil, Jornal da USP e Folha de São Paulo.


